Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicenter, open-label, global, phase 3, randomized, controlled trial.
Sezer A, Kilickap S, Gümüş M, Bondarenko I, Özgüroğlu M, Gogishvili M, Turk HM, Cicin I, Bentsion D, Gladkov O, Clingan P, Sriuranpong V, Rizvi N, Gao B, Li S, Lee S, McGuire K, Chen CI, Makharadze T, Paydas S, Nechaeva M, Seebach F, Weinreich DM, Yancopoulos GD, Gullo G, Lowy I, Rietschel P.
Lancet. 2021 Feb 13;397(10274):592-604.
Lancet誌2021年2月13日号に掲載。
PD-1に直接的に作用する強力な完全ヒト・ヒンジ安定化IgG4モノクローナル抗体cemiplimabは、根治的手術や根治的放射線治療が適応とならない転移を有する局所進行皮膚有棘細胞がんの治療薬として米国などで承認されており、進行固形腫瘍では他のPD-1阻害薬と同程度の抗腫瘍活性と安全性プロファイルが確認されている。このRegeneron PharmaceuticalsとSanofiの助成によるEMPOWER-Lung 1試験ではPD-L1発現率≧50%の進行非小細胞肺がん(NSCLC)患者の治療において、cemiplimab単剤療法はプラチナ製剤ベースの2剤併用化学療法と比較して、全生存(OS)期間および無増悪生存(PFS)期間を有意に延長し、1次治療の新たな選択肢となる可能性があることが示された。
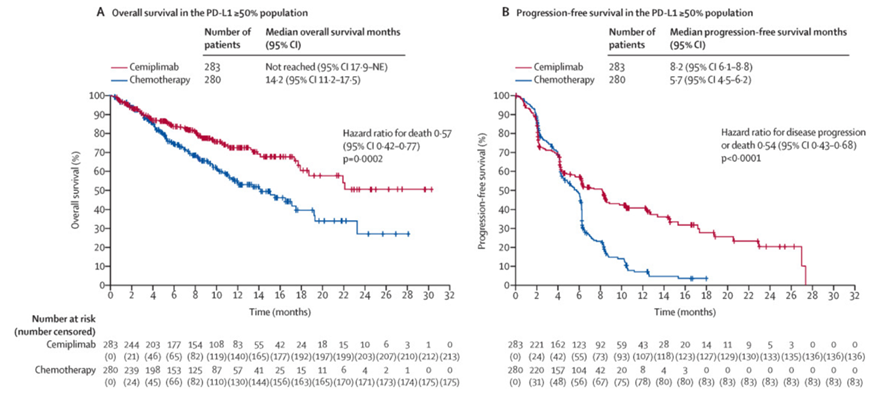
2017年6月~2020年2月の期間に、24ヵ国138施設で、進行NSCLCの1次治療におけるcemiplimabの有用性を評価する目的で、国際的非盲検無作為化対照比較第III相試験を実施した。対象は、年齢18歳以上、病理学的にStage IIIB/IIIC/IVのNSCLCと確定され、全身状態ECOG PSが0/1の患者で、生涯非喫煙者は除外された。cemiplimab(350mg、3週ごと)群、またはプラチナ製剤ベース2剤併用化学療法群に1対1の割合で無作為に割り付けられた。後者には病勢進行後にcemiplimabへのクロスオーバーが許容された。主要エンドポイントは、マスクされた独立審査委員会の評価によるOS期間およびPFS期間とし、intention-to-treat(ITT)集団およびPD-L1発現率≧50%の集団で評価された。
710例(ITT集団)が登録され、cemiplimab群に356例(年齢中央値63歳、女性12%)、化学療法群には354例(64歳、17%)が割り付けられた。このうちPD-L1発現率≧50%の患者は563例で、cemiplimab群283例(63歳、12%)、化学療法群280例(64歳、18%)だった。化学療法群の病勢進行例は203例で、このうち150例(74%)がクロスオーバーとしてcemiplimabの投与を受けた。PD-L1発現率≧50%の集団におけるOS期間中央値は、cemiplimab群が未到達(95%信頼区間[CI]:17.9~評価不能)、化学療法群は14.2ヵ月(11.2~17.5)であり、ハザード比(HR)は0.57(0.42~0.77)と、cemiplimab群で有意に良好であった(p=0.0002)。また、2年OS率は、cemiplimab群50%(36~63)、化学療法群27%(14~43)だった。PFS期間中央値は、cemiplimab群が8.2ヵ月(95%CI:6.1~8.8)と、化学療法群の5.7ヵ月(4.5~6.2)に比べ有意に延長した(HR:0.54、95%CI:0.43~0.68、p<0.0001)。また、1年PFS率は、cemiplimab群41%(34~48)、化学療法群7%(4~12)だった。客観的奏効率は、cemiplimab群が39%(111/283例、CR:6例[2%]、PR:105例[37%])、化学療法群は20%(57/280例、CR:3例[1%]、PR:54例[19%])であり(オッズ比[OR]:2.53、95%CI:1.74~3.69、p<0.0001)、奏効期間中央値はそれぞれ16.7ヵ月および6.0ヵ月であった。一方、ITT集団でも、高いクロスオーバー率(74%)にもかかわらず、OS期間中央値(22.1ヵ月[95%CI:17.7~評価不能]vs.14.3ヵ月[11.7~19.2]、HR:0.68[95%CI:0.53~0.87]、p=0.0022)およびPFS期間中央値(6.2ヵ月[4.5~8.3]vs.5.6ヵ月[4.5~6.1]、0.59[0.49~0.72]、p<0.0001)は、いずれもcemiplimab群で有意に良好であった。
治験薬投与中に発現したGrade3/4の有害事象は、cemiplimab群が28%(98/355例)、化学療法群は39%(135/342例)で認められ、cemiplimab群では肺炎(16例で5%)、貧血(12例で3%)、低ナトリウム血症(9例で3%)の頻度が高く、化学療法群では貧血(56例で16%)、好中球減少(35例で10%)、血小板減少(28例で8%)が高頻度にみられた。
この結果を見ると、ペムブロリズマブ単剤のKEYNOTE-024試験に良く似ていて、3剤目の抗PD-1抗体の有効性が再び確認されたということになる。またOSとPFSのサブグループ解析で、ベースラインで脳転移がある患者に対してもcemiplimabの効果があるが、ニボルマブやペムブロリズマブでも脳転移のある患者に対する効果は報告されており、新しい薬というよりは同じ系統の薬がまた1つ増えたというくらいの感覚である。併用療法の開発も進めており、企業としては将来的に比較試験を行うための自社製品のプラットフォーム薬剤にしたいという意味合いも、この試験にはあるかもしれません。